异体基因CAR T细胞的扩增
自从Steven Rosenberg的开创性工作以来,已经确定非清髓性和淋巴清除性化学疗法是有效体内扩增施用的T细胞所必需的。T细胞在转移到淋巴细胞减少的宿主后会经历一个称为稳态扩张的过程。这种扩张是由IL-7和IL-15等稳态细胞因子以及暴露于自身抗原和其他抗原驱动的。因此,大多数CAR-T细胞治疗方案中都包括淋巴细胞消减。
最佳预处理方案尚未确定,但包括细胞毒性药物环磷酰胺和氟达拉滨在内的方案已被用于几乎所有当前的CAR-T细胞研究,因为该组合具有耐受性和淋巴细胞清除特性。早期试验中给予高剂量IL-2以增强T细胞扩增,但后来由于缺乏益处证据而没有使用。增加淋巴清除的强度可能导致调节性T细胞的耗竭和注入的T细胞的更多植入。然而,这种策略受限于大剂量化疗的相关毒性和细胞因子释放综合征的高风险。值得注意的是,CAR T细胞的初始增殖是获得足够比例的效应细胞与靶细胞所必需的,这可能是这种治疗方法成功的主要因素,据报道,输注后CAR T细胞扩增与在ALL自体CD19 CAR T细胞的情况下有反应。
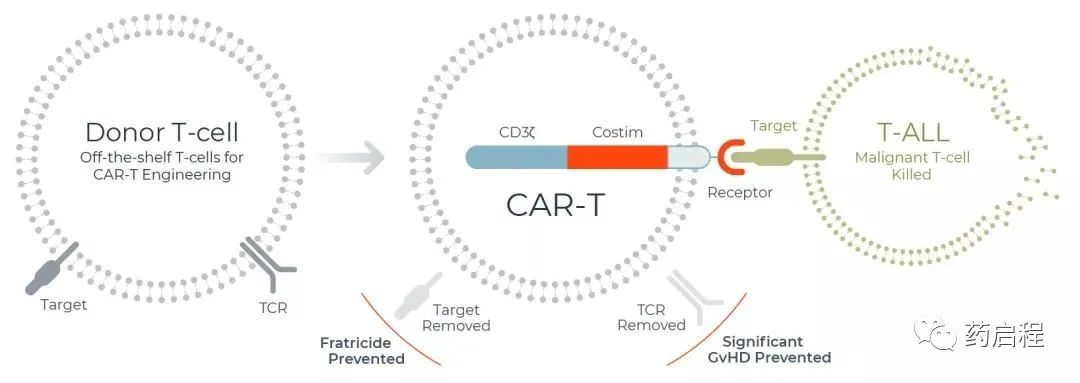
具有TCR破坏的同种异体CAR T细胞的扩增可能是由CAR本身在靶抗原存在下的激活和/或由稳态细胞因子驱动的。在这种情况下,TCR破坏如何影响体内T细胞增殖仍然未知。然而,同种异体CAR T细胞上不存在TCR表达可能是一个优势,因为当与CAR激活相结合时,TCR参与会对CD8+ CAR T细胞扩增产生负面影响。然而,上述结果是针对具有受控TCR反应性和同源TCR抗原表达的同系鼠模型报告的,因此在得出明确结论之前需要来自临床的更多转化数据。使用UCART19获得的初步数据表明,同种异体CAR T细胞可以在患者体内有效扩增。
有趣的是,从这些早期结果中注意到,尽管使用了相同的细胞产品,但仍观察到患者间的变异性,这表明宿主因素也参与了注入的T细胞的扩增。最后,淋巴清除的质量可能在同种异体策略中更为重要,因为持续存在的宿主T细胞可能会立即排斥表达MHC的同种异体CAR T细胞。
同种异体CAR T细胞的持久性
在自体CAR T细胞策略中,一些长期缓解与治疗后数月或数年的 CAR T细胞检测相吻合。然而,CAR T细胞持续的最佳持续时间可能因疾病的性质、肿瘤负荷和其他因素而异,例如施用的T细胞的效力和 CAR的分子设计。从理论上讲,可以考虑两种疾病情景。
在第一个情况中,大多数表达靶抗原的肿瘤细胞都可以被CAR T细胞所接触。如果扩增后效应物与靶细胞的比例足够,则在消除肿瘤细胞后可能不需要维持长期持久性。
在第二种情况下,这可能更常见,本质上对 T 细胞杀伤不敏感的肿瘤细胞群持续到临床完全缓解(作为静止干细胞)。在这种情况下,有必要设想CAR T细胞对残留疾病的长期控制。从这个方面来说,自体CAR T细胞具有潜在的长期持续存在的优势。然而,由于同种异体方法不受 T 细胞数量的限制,它允许在所有患者中重新管理CAR T细胞,靶向相同或其他肿瘤抗原(图 2)。
因此,我们可以设想在第一次给药后进行几个同种异体CAR T细胞给药疗程,作为一种巩固治疗,旨在维持足够数量的CAR T细胞,从而消除持续存在的肿瘤细胞。值得注意的是,在两名患者(一名复发的患者和一名对第一次UCART19给药没有反应的患者)的I期试验中,已经对同种异体CAR T细胞重新给药的概念进行了证明。如前所述,在重新给予表达HLA的CAR T细胞之前应检查DSA的存在,并且在先前免疫的情况下应使用来自另一个供体的CAR T细胞。另一个限制是与每次CAR T细胞给药前所需的淋巴清除相关的毒性。有必要限制淋巴清除的强度和巩固周期的数量,从而开发优化的同种异体CAR T细胞,如下所述。
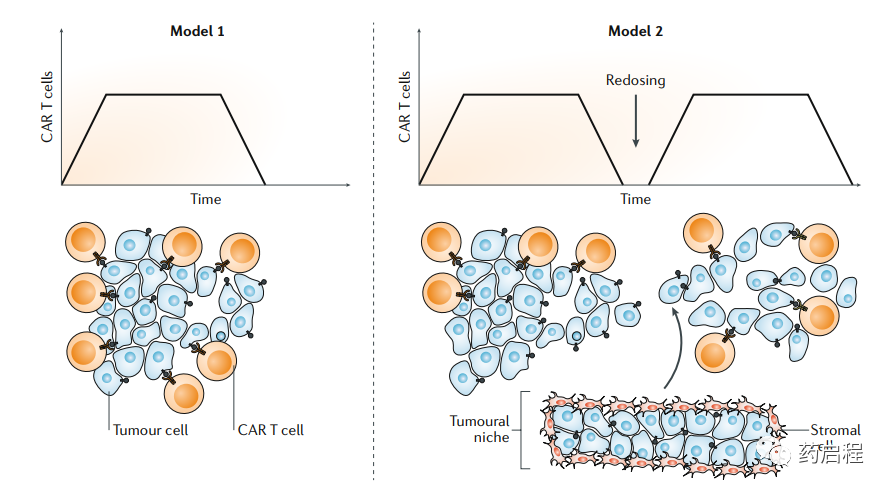
图 2:CAR T 细胞的持久性和肿瘤进化。根据嵌合抗原受体(CAR) T细胞的持久性要求,理论上可以考虑两种肿瘤模型。在肿瘤模型1中,大多数肿瘤细胞表达靶抗原(以肿瘤细胞上的条形表示)并被CAR T细胞识别。如果在CAR T细胞初始扩增后效应物(例如CAR T细胞)与靶标(在这种情况下为肿瘤细胞)的比例足够,则有效杀死肿瘤细胞可以根除肿瘤。在肿瘤模型2中,一些肿瘤细胞不表达靶抗原和/或由于它们位于赋予对癌症治疗抵抗力的生态位(此处表示为被基质细胞包围的肿瘤细胞)中而免受CAR T细胞杀伤。这些受保护的肿瘤细胞将持续存在并重新填充肿瘤块。在这种情况下,需要CAR T细胞长期存在以消除剩余的肿瘤细胞,或者应采用CAR T细胞再给药的策略。同种异体方法的一个主要优势还在于可以依次施用具有不同靶特异性的CAR T细胞,以避免出现不表达初始靶抗原的克隆。
同种异体CAR T细胞消除肿瘤细胞的治疗窗口取决于初始扩增和持续时间长短以及宿主免疫系统排斥它们的能力。避免同种异体CAR T细胞排斥的一种正式可能性是使用与大多数人群的HLA等位基因匹配的T 细胞库。器官和UCB移植的经验表明,最重要的HLA等位基因匹配是HLA-A、HLA-B和HLA-DR,这些基因座的匹配足以降低同种异体移植排斥的发生率。计算表明,这可以通过有限数量的 HLA-A、HLA-B 和 HLA II类组织相容性抗原HLA-DRB1纯合的供体来实现。理论上,鉴于有合适的供体,有人建议从150名选定的纯合HLA型志愿者中建立的细胞库可以匹配93%的英国人口。
增加同种异体CAR-T细胞持久性的第二种可能性是修改预处理方案以延长淋巴细胞减少的持续时间而不影响CAR-T细胞活性。同种异体 CAR T细胞很可能需要比自体CAR T细胞更强烈的淋巴清除。在这种情况下,基因编辑技术提供了许多可能性,例如通过破坏CD52对阿仑单抗产生耐药性的CAR T细胞。概念的临床前证明表明,在淋巴瘤原位小鼠模型中,TCR和CD52缺陷型CD19 CAR T细胞可以在阿仑单抗存在的情况下选择性移植,同时保持与标准CD19 CAR T细胞无法区分的抗肿瘤活性。
在临床上使用UCART19获得的初步I期结果支持这一基本原理 。通过在这些细胞中破坏脱氧胞苷激酶(一种参与将核苷前药转化为有毒化合物的关键酶),也可以使同种异体CAR T细胞对预处理淋巴清除方案中使用的嘌呤核苷酸类似物产生抗药性。这种方法允许扩增和恢复同质的工程化CAR T细胞群,这些细胞在存在淋巴细胞消耗剂量的不同嘌呤核苷酸类似物的情况下保持其增殖能力和对肿瘤细胞的溶细胞活性。然而,使用增加淋巴清除深度和持续时间的预处理方案可能会增加机会性感染和病毒再激活的风险。因此,这种方法仅限于治疗经过精心挑选的血液系统恶性肿瘤患者,并且可能不适用于实体瘤,在实体瘤中,标准实践中只接受较低水平的毒性。此外,对于同种异体CAR T细胞的再给药,很难重复进行强烈的淋巴清除。
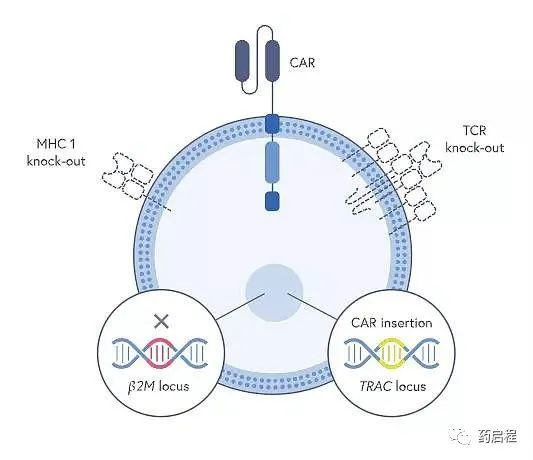
因为HLA I类分子是免疫排斥的关键介质,第三种方法是删除同种异体CAR T细胞上的MHC I类分子。这可以通过破坏 β2-微球蛋白来实现,这对于在细胞表面形成功能性HLA I类分子至关重要。由于HLA分子作为NK细胞的主要配体抑制剂,完全不存在HLA I类分子可能使同种异体CAR T细胞对NK细胞识别和破坏更敏感。然而,这种“缺失自我”的概念在同种异体环境中的价值可能较低,尤其是在受体NK细胞上的杀伤细胞免疫球蛋白样受体(KIR)与其配体 (HLA I类分子) 之间不匹配的情况下T 细胞,在这种情况下,NK细胞反应性可能在 HLA I 类分子缺失之前就已经存在。
此外,NK细胞在某些恶性肿瘤中的溶细胞功能可能较差。例如,在急性髓性白血病(AML)中报告了激活分子(如天然细胞毒性受体)表达的缺陷。因此,应在临床环境中认识到破坏HLA I类阴性同种异体CAR T细胞的风险。防止NK细胞依赖性裂解的一种吸引人的策略是在CAR T细胞上插入非经典HLA分子 HLA-E或HLA-G(结合NK细胞上的抑制性受体)或过表达siglec 7和siglec 9配体(抑制表达抑制性受体siglec 7 和 siglec 9)的 NK 细胞。
最后,活化的 T 细胞也表达高水平的 HLA II类分子,这也可能与同种异体CAR T细胞的排斥有关。HLA II类表达的抑制可以通过破坏控制MHC II类基因转录的调节因子来实现,例如编码MHC II类反式激活因子(CIITA)和 RFXANK的那些。需要转化数据来确定最有效的基因编辑策略,以避免排斥同种异体CAR T细胞。这对于同种异体的发展至关重要使人体系统不可见的CAR T细胞可以扩大适应症,特别是在实体瘤领域。
确定在CAR-T细胞制造过程中选择的最佳T细胞亚群
T细胞是一个异质群体,具有不同的表型和功能(方框 2)。
已经在小鼠和非人类灵长类动物中使用过继性T细胞转移进行了不同的研究,以描述不同T细胞亚型的作用。尽管CD8+效应记忆T细胞(TEM细胞)具有很强的细胞毒性,但只有中央记忆T细胞(TCM细胞)和其他分化程度较低的T细胞亚群,如TN细胞和干细胞样记忆 T 细胞(TSCM 细胞)对体内扩增、存活和长期持久性至关重要。
临床前结果表明,由CD8+和CD4+ TN细胞和TCM细胞亚群产生的 CAR T细胞比来自TEM细胞亚群的细胞更有效,并强调了以特定比例使用 CD8+和CD4+ T细胞亚群的兴趣。
在临床环境中,发现与TN或TSCM细胞相对应的表达CD8、蛋白酪氨酸磷酸酶受体C型 (PTPRC;也称为CD45RA) 和 CC-趋化因子受体7 (CCR7)的T细胞亚群的频率相关随着淋巴瘤患者体内CAR T细胞的整体扩增。
从慢性淋巴细胞白血病患者的自体CD19 CAR T细胞中获得的数据表明,TSCM细胞和TCM细胞的数量以及缺乏耗竭标志物——例如程序性细胞死亡1 (PD-1)、T细胞免疫球蛋白粘蛋白受体3。TIM3;也称为 HAVCR2) 或淋巴细胞激活基因3蛋白 (LAG3)是持久性和活性的主要参数。CAR-T细胞疗法的持续性也被证明取决于CD4+ T细胞的数量。
自体CAR-T细胞疗法的一个潜在问题是,与TSCM和TCM细胞相比,以前接受过淋巴细胞毒性化疗的患者通常淋巴细胞减少,并且TEM细胞的频率更高。因此,同种异体方法的一个显着优势是能够选择具有更高频率的TN、TSCM和TCM 细胞的供体,并控制CAR-T细胞制造过程以确定输注T细胞的特定特征,例如最佳比例最终细胞产物中CD4+和CD8+亚群中TSCM细胞、TCM细胞、TEM细胞和终末分化效应记忆T细胞(TEMRA细胞)的亚群。
在CAR工程之前对不同的T细胞亚群进行免疫磁性分离可以使输注的产品更加均匀,并且可以在转导之前选择分化程度较低的T细胞亚群。然而,这种方法显着增加了CAR T细胞生成的复杂性。培养条件也可以适应放大一些特定的子集。例如,IL-7和IL-15在CAR T细胞的离体扩增过程中增加了CD8+CD45RA+CCR7+细胞的频率。培养基也可能强烈影响细胞代谢和非终末分化记忆T细胞表型的维持。最后,转导方法本身可能有利于选择特定的T细胞亚型。使用piggyBac转座产生的 CAR T 细胞已被证明主要属于 TSCM 表型。
需要进行转化研究以更好地了解初始扩增、持久性和同种异体方法中施用的CAR T细胞的特征之间的联系。这将为优化细胞产物的免疫组成提供线索。尽管如此,我们可以推测,受控的TSCM细胞+ TCM细胞/TEM细胞+TEMRA 细胞的比例将在持久性和功效方面具有显着优势。
方框 2 记忆T细胞亚型
通过表达淋巴归巢受体CC-趋化因子受体7(CCR7)和CD62配体(CD62L),幼稚T细胞 (TN细胞) 通过淋巴系统在次级淋巴器官和血液之间持续循环。响应外周抗原,TN细胞会增殖并分化为不同类型的效应和记忆T细胞,然后迁移到不同的组织。
中央记忆T细胞 (TCM 细胞) 位于次级淋巴器官中,其特征在于其表面表达CD45RO、CCR7和CD62L。TCM细胞显示出自我更新的能力,但效应功能水平较低。
效应记忆T细胞(TEM细胞)存在于非淋巴外周组织类型中,包括肺、肝和肠,并且可以在血液和组织之间再循环。它们在其表面表达CD45RO,但不表达CD62L或CCR7。它们根据其细胞毒性特性分泌效应细胞因子,例如IL-4 和干扰素-γ,以及穿孔素和颗粒酶B。TEM细胞在细菌、病毒和寄生虫感染中发挥重要作用。
终末分化的效应记忆T细胞(TEMRA 细胞)重新表达CD45RA,这是通常在TN细胞上发现的标记物(CD45RA在TCM和TEM细胞中丢失,在其中被CD45RO同种型取代)。
干细胞样记忆T细胞(TSCM细胞)具有类似干细胞的自我更新特性,可以持续数十年,并且与其他记忆T细胞相比具有更高的增殖能力。它们的特点是表达CD45RA、CCR7、CD95、CD122、CXC-趋化因子受体3 (CXCR3)和整合素CD11a(β2 亚基)。IL-7和IL-15参与TSCM细胞的产生和扩增。
常驻记忆T细胞 (TRM细胞) 是一种持久的细胞群,主要位于外周淋巴和非淋巴组织,如肺、皮肤和胃肠道和泌尿生殖道。它们的特点是表达表面标志物,如CD103、CD69 和 CD49a,并且不存在淋巴结归巢受体CD62L和CCR7。它们的分化受转化生长因子-β 和 IL-15 的调节(参考文献 165,166)。
本文摘自---药精通 Bio
Feel free to call us on
025-85998075
Drop us a line anytime at
sales@popebiotech.com,
and we’ll get back
soon.
Come visit us at 南京市江宁区科学园乾德路5号