上月,荷兰生物技术公司argenx宣布其核心产品VYVGART®Hytrulo(Efgartigimod,艾加莫德皮下注射剂)用于治疗慢性炎性脱髓鞘性多发性神经根神经病(CIDP)成人患者的ADHERE研究达到主要终点。与安慰剂相比,VYVGART®Hytrulo可降低复发风险61%(HR: 0.39 95% CI: 0.25; 0.61)。
CIDP是一种罕见且严重的自身免疫性周围神经系统疾病,虽然发病机制尚未明确,但越来越多证据表明,IgG抗体在周围神经损伤中起关键作用。患有CIDP的患者会感到疲劳、肌肉无力以及四肢感觉丧失,随着时间的推移这些症状可能会变得更加严重。如果不进行治疗,三分之一的CIDP患者将不得不依靠轮椅生活。此次VYVGART®Hytrulo的积极结果无疑将为这类自免疾病患者带来曙光。
消息公布当日,argenx股价涨幅超过27%,市值逼近270亿美元,在7月底,公司市值一度超过300亿美元。自2017年在纳斯达克上市以来,argenx公司总市值从不到10亿美元一路上涨,穿越周期,造就了“6年30倍”的传奇,优异的表现吸引各方关注。
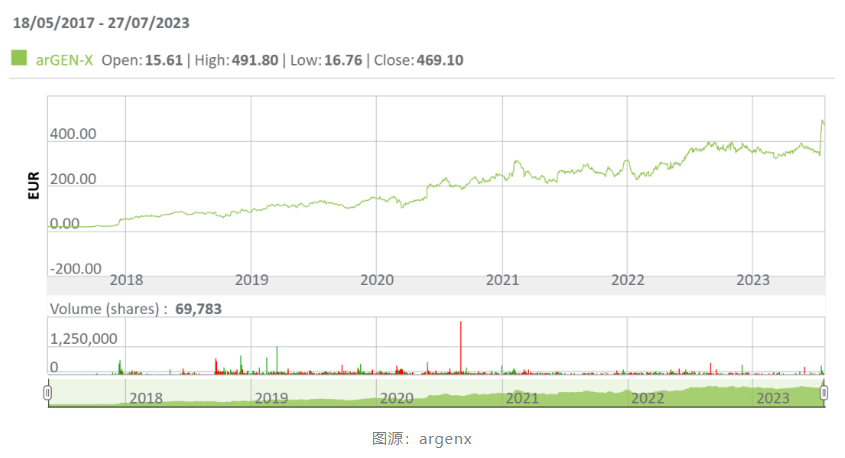
这样一家专注于自身免疫性疾病疗法公司的亮眼战绩让整个自免疾病领域迎来新的“高光时刻”。
相较于竞争白热化、内卷严重的肿瘤领域,自免疾病依然算是一个蓝海领域,同时也是重磅药物频出的领域,比如艾伯维的Humira(阿达木单抗)、强生的Stelara(乌司奴单抗)以及赛诺菲的Dupixent(度普利尤单抗)、诺华的Cosentyx(司库奇尤单抗)等。
根据美国自身免疫相关疾病协会(AARDA)统计,目前已发现100多种自身免疫性疾病,受累人群比例达全球人口总数的7.6%~9.4%。然而,目前全球已上市的自免治疗药物只覆盖了不到30种适应症,还有许多未满足的临床需求等待被发掘。同时,由于自免疾病发病机制复杂,同一种疾病可能涉及多个通路,许多新靶点正等待被开发。
与其他治疗领域不同的是,自身免疫性疾病大多难以治愈,多数患者需长期用药,甚至终身用药,慢病特点使得自免疾病领域成为了仅次于肿瘤的全球第二大药物市场。
根据弗若斯特沙利文报告,全球自身免疫性疾病药物市场在2021年达到1277亿美元,估计在2030年将达到1760亿美元,复合年增长率为3.6%。中国的自免药物市场在2021年为30亿美元,由于庞大的患者群体以及创新疗法的不断进入,预计2030年将增长至约231亿美元,复合年增长率为25.5%。
在国内,由于创新药研发起步较晚,尤其是生物药开发存在一定壁垒,自免领域的创新药品供给长期不足,导致长期以来国内临床上自免疾病药物多局限于小分子药物制剂,如全身性免疫抑制剂(甲氨蝶呤、硫唑嘌呤等、环孢素)、非甾体抗炎药(NSAIDs)和甾体抗炎药(SAIDs)。同时,由于患者用药的可及性仍存在不足,疾病认知不充分,治疗意识薄弱,也制约了自免领域新药在国内市场放量。2021年,生物药在国内自免疾病领域药物市场的份额不到三分之一(32.9%),远低于同年全球水平(69.8%)。国内自免生物药的低渗透率意味着这一治疗领域依然存在许多未满足的临床需求。
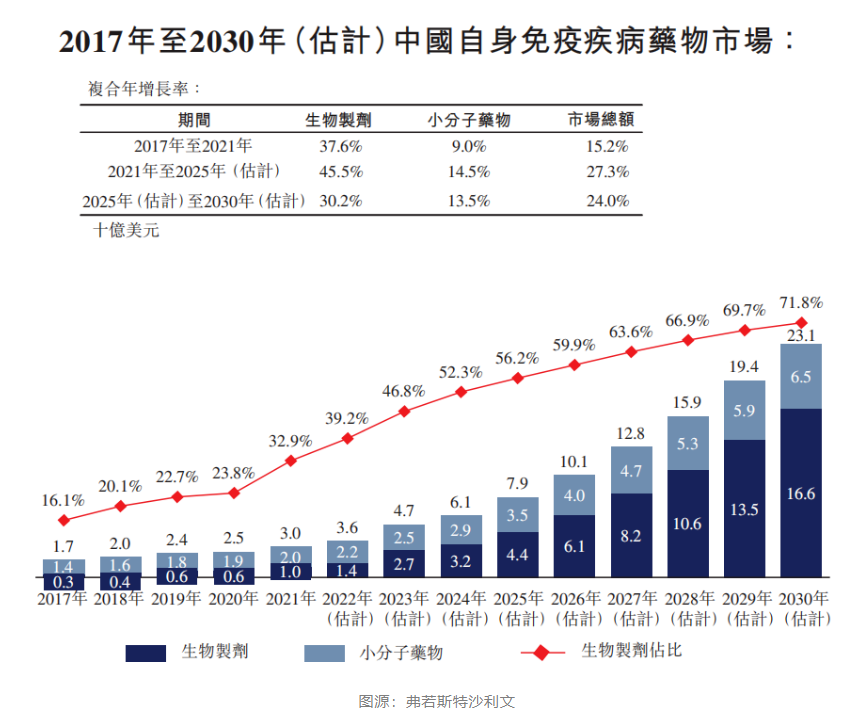
近年来,国内药品审评审批制度改革加速深化推进,鼓励药品创新政策红利不断加码,新药上市速度加快,让更多患者用上新药、好药。然而,长期以来国内自免领域新药市场,尤其是生物药市场多被国外企业所占据,本土自研产品寥寥无几。而近年来,许多国内企业开始将目光瞄向自免领域,以期分一杯羹。
药融圈获悉,今年6月,国内抗体新药开发公司智翔金泰在科创板成功上市,发行价37.88元,募资总额近35亿元。据招股书披露,该公司现已形成从分子发现、工艺开发与质量研究、临床研究到商业化生产的完整抗体药物研发生产流程。本次IPO募集资金将用于抗体产业化基地建设、抗体药物研发及补充流动资金。
从智翔金泰的管线布局上不难看出,自身免疫性疾病是该公司重仓的治疗领域,拥有5款在研产品,在适应症方面涵盖了皮肤、呼吸、胃肠、关节等领域的多个疾病,如银屑病、中轴型脊柱关节炎、哮喘、系统性红斑狼疮、特应性皮炎、炎症性肠病等。
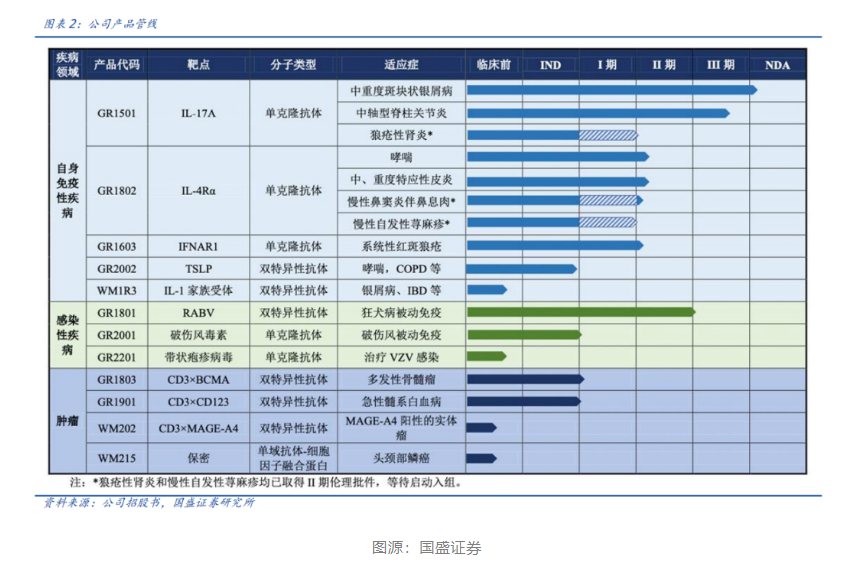
智翔金泰管线中进展最快的产品赛立奇单抗(Xeligekimab)注射液已于2023年3月提交新药上市申请并获受理,是首个申报上市的国产IL-17A单抗,适应症为中重度斑块状银屑病,预计将在2024年初获批,有望成为首款获批治疗斑块状银屑病的国产IL-17A单抗。
《中国银屑病诊疗指南(2023版)》指出,早期启用生物制剂不仅可以促进银屑病皮损临床组织学上的逆转,改善炎症性共病的症状和体征,还可以降低患者停药后复发的风险,有利于银屑病的全面管理。美国银屑病基金会提倡拒绝阶梯治疗,建议第一时间选择最适合的治疗。目前生物制品正逐渐成为银屑病的首选治疗手段,但现阶段国内银屑病的治疗依然是以外用药和中药为主,创新生物药的渗透率低。
在国内获批的银屑病治疗生物制剂中,主要靶点包括TNF-α、白细胞介素12/23(IL-12/23)、IL-23,以及IL-17A。其中TNF-α、IL-12/23靶点的抑制剂虽然在国内较早获批,但由于早期治疗费用高昂,并未打开国内银屑病治疗市场,且TNF-α抑制剂主要市场并不在于银屑病,而是在于类风湿性关节炎、炎症性肠病等适应症。因此靶向IL-23、IL-17A产品正在成为国内银屑病治疗的主要生物制剂。
目前国内银屑病生物制剂大部分市场份额由诺华公司的司库奇尤单抗占据,药融云数据显示,2022年司库奇尤单抗在全国医院销售总额高达14亿元。司库奇尤单抗是一款靶向IL-17A的全人源IgG1k单克隆抗体,2019年在国内获批,2021年进入医保,在医保降价之后迅速打开了国内市场,可见其在医生和患者群体中的受欢迎程度,也表明这背后存在巨大的用药需求。
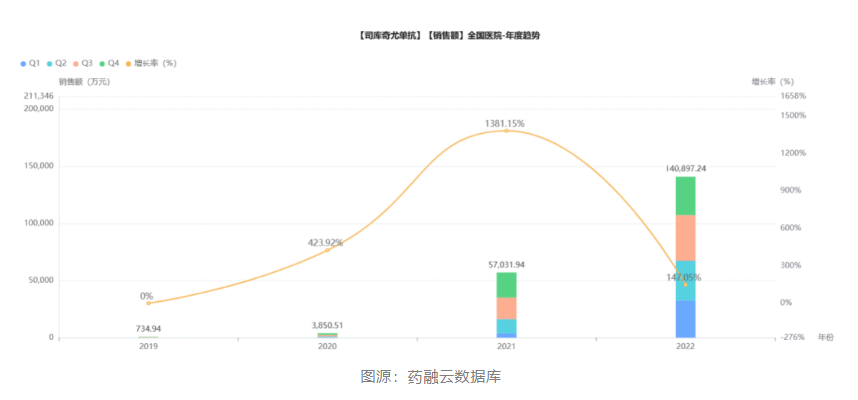
智翔金泰的赛立奇单抗注射液对标的正是诺华的司库奇尤单抗。该IL-17A抗体基于智翔金泰新型噬菌体呈现系统的单抗药物发现技术平台开发,临床前主要药效学研究结果显示,赛立奇单抗可选择性地与IL-17A结合,抑制IL-17RA的下游信号转导,抑制IL-17A诱导的炎性反应,其疗效与司库奇尤单抗相当。赛立奇单抗在3期临床试验中也取得积极成果。GR1501-004是一项评价GR1501(赛立奇单抗)注射液治疗慢性中、重度斑块状银屑病患者有效性和安全性的随机、双盲、安慰剂对照、多中心临床研究。研究结果显示:GR1501产品200mg组12周在PASI75应答为90.7%,GR1501产品药效良好。
若赛立奇单抗注射液成功获批,将成为首个国内厂家自主研发的IL-17A单抗,率先赢得市场份额,商业化前景确定性较高。
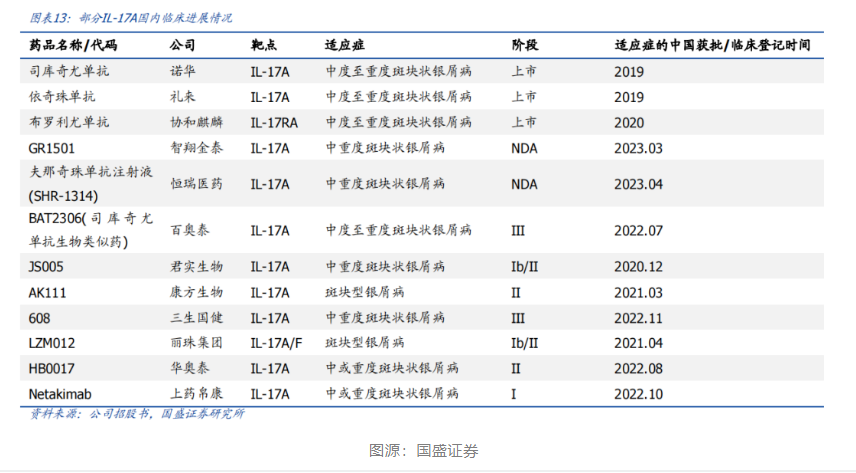
同时,智翔金泰针对赛立奇单抗注射液的布局不止于此,该药用于中轴型脊柱关节炎的3期临床试验正在进行中,也是该适应症进展最快的国产IL-17A抗体之一;同时,该药针对狼疮性肾炎适应症正在开展2期临床试验。
智翔金泰在自免领域的另一大产品GR1802是一款抗IL-4Rα单抗,被开发用于治疗哮喘、中重度特应性皮炎、慢性鼻窦炎伴鼻息肉,以及慢性自发性荨麻疹。
IL-4Rα为白细胞介素4(IL-4)和白细胞介素-13(IL-13)共用的一个受体亚基。抗IL-4Rα单抗通过靶向IL-4Rα,可以同时抑制IL-4/IL-13通路的信号传导,实现双靶点抑制的创新作用机制,在近几年成为了免疫炎症性疾病领域的明星靶点。
目前全球范围内针对IL-4Rα靶点仅有赛诺菲的度普利尤单抗获批,且已斩获多项适应症,如特应性皮炎、哮喘、慢性鼻窦炎伴鼻息肉、嗜酸性食管炎和结节性痒疹,是美国首款横跨皮肤科、变态反应、呼吸科科室用药的生物制剂。该产品2022年全球销售额高达约87亿美元,未来有望成为百亿美元的重磅产品。度普利尤单抗在国内获批用于治疗特应性皮炎。药融云数据显示,2022年度普利尤单抗在全国医院销售总额达10.62亿元。
度普利尤单抗目前在国内并未批准哮喘适应症,而智翔金泰的GR1802重点开发的适应症之一便是哮喘。2012~2015年,在中国10个省市进行的“中国肺健康研究”,调查结果显示,我国20岁及以上人群的哮喘患病率为4.2%,其中26.2%的哮喘患者已经存在不可逆的气流受限。因此哮喘的治疗在国内仍存在未被满足的临床需求。
在B-hIL-4/hIL-4RA双人源化小鼠建立哮喘模型和特应性皮炎模型上,GR1802各剂量组均能显著改善模型动物的临床症状和实验室指标,具有明确的量效关系,与同剂量的度普利尤单抗药效相当。
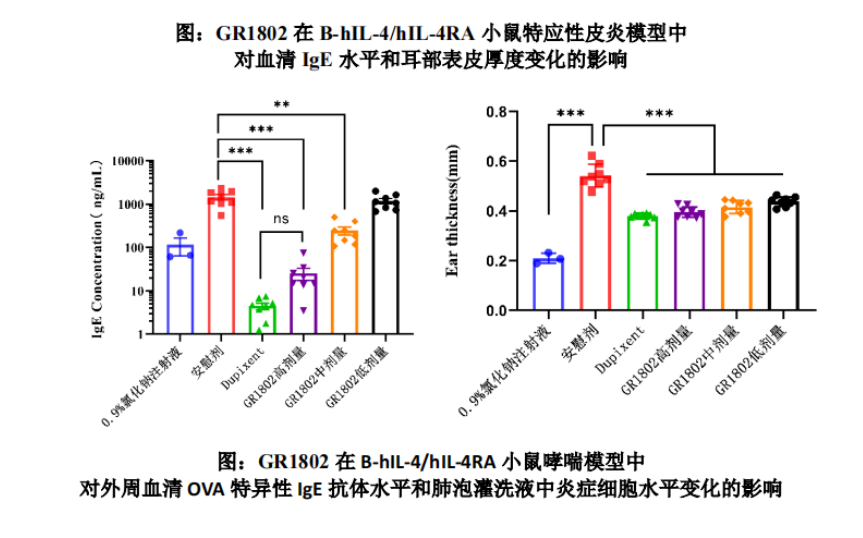
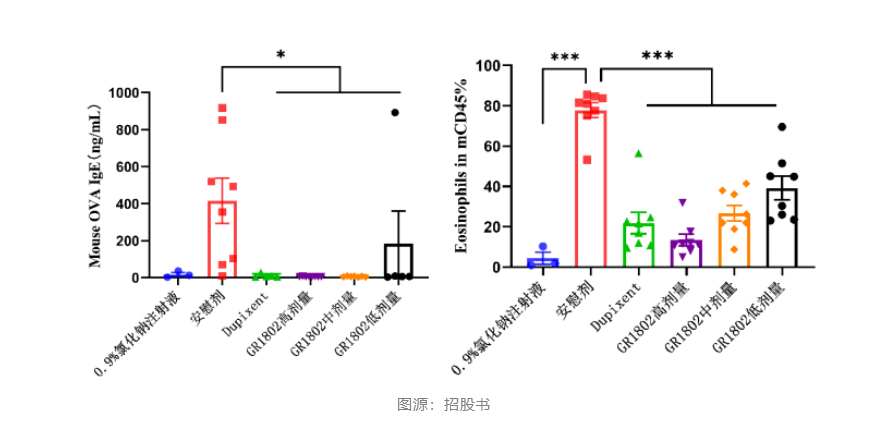
目前GR1802正在开展治疗哮喘的2期临床试验,预计在2024年一季度启动3期临床,预计2027年GR1802哮喘适应症获批上市,惠及国内患者。
针对特异性皮炎适应症,GR1802已在2022年2月完成临床1b、2期受试者入组,预计2023年四季度开展中重度特应性皮炎适应症的3期临床试验,2026年GR1802中重度特应性皮炎适应症获批上市。
而对于慢性鼻窦炎伴鼻息肉,目前国内尚无生物制品获批上市,GR1802用于治疗慢性鼻窦炎伴鼻息肉已经完成1期临床试验,2期临床试验处于受试者入组阶段。
智翔金泰在自免领域还拥有国内企业首款进入临床的抗IFNAR1单抗GR1603,用于系统性红斑狼疮。
IFNAR包括IFNAR1和IFNAR2,是I型干扰素共有的受体。IFNAR1结合I型IFN后,可激活对调节生长、存活、分化、病原体抗性和抗病毒免疫至关重要的JAK-STAT信号通路,触发许多蛋白质的酪氨酸磷酸化,包括JAK、TYK2、STAT蛋白质等,在免疫、肿瘤等领域发挥重要作用。
目前全球范围内靶向IFNAR1的仅有阿斯利康的Anifrolumab(阿尼鲁单抗)获批上市,但尚未在国内获批。针对系统性红斑狼疮全球范围内仅有3款生物药上市,由于该病发病机制不清和疾病的异质性,新药研发难度高。根据《2020中国系统性红斑狼疮诊疗指南》,系统性红斑狼疮现有疗法仍存在反应率不足、复发风险高、副作用明显、生物治疗药物选择受到限制以及生物治疗在疾病早期阶段的可及性受到限制等。因此系统性红斑狼疮领域仍存在未被满足的临床需求。
临床前研究显示,智翔金泰的GR1603与人IFNAR1明显结合,显著拮抗I型IFN诱导的各种生物学活性,其活性与Anifrolumab相当。目前GR1603针对系统性红斑狼疮正在开展1b/2期临床试验,预计2024年启动3期临床试验,2027年有望上市,惠及国内患者。
自2016年开始,智翔金泰就启动双特异性抗体药物技术平台的建设和优化,目前已经建立起两种结构的双特异性抗体开发技术平台。第一种为比较经典的scFv+Fab双抗结构,第二种为基于共同轻链的Fab+Fab双抗结构。
在自免领域,智翔金泰布局了两款双抗产品:靶向TSLP双表位的双抗GR2002,适应症为哮喘、COPD等,目前已取得药物临床试验批准通知书;以及靶向IL-1家族受体的双抗WM1R3,适应症为银屑病、IBD等。
在国内,自身免疫性疾病过去常被认为是“疑难杂症”,创新疗法发展较晚,用药可及性不足,疾病认识不足,许多病种的新药市场被跨国药企所占据。但是随着国内随着医疗水平的提高,检测手段的进步,越来越多的患者获得有效诊断,这一疾病领域的用药需求将会迅速扩大。
在自免新药研发端,一些国内企业已经开始奋起直追,本土自研产品即将进入商业化阶段,搅动国内市场。对于此次IPO的智翔金泰,未来一两年将是公司发展的关键期,赛立奇单抗的上市和商业表现、GR1802在哮喘等适应症中的推进,以及其他在研产品的临床表现,都将吸引无数目光。这家抗体新药开发公司是否能在自免这一蓝海市场占有一席之地,我们可以拭目以待。
Feel free to call us on
025-85998075
Drop us a line anytime at
sales@popebiotech.com,
and we’ll get back
soon.
Come visit us at 南京市江宁区科学园乾德路5号