目前,全球已有几款溶瘤病毒产品获批上市,包括赛百诺的今又生、Latima的Rigvir、三维生物的安柯瑞、安进的Imlygic以及第一三共的Delytact。但是部分产品疗效和安全性不被市场认可,大多产品销量惨淡。根据最新的市场研究数据显示,2023年,全球溶瘤病毒产品销售额约为7833万美元,2024年全球溶瘤病毒疗法市场规模达到10.2亿美元。虽然溶瘤病毒产品在全球范围内的销售额仍处于较低水平,但随着技术的进步和市场的拓展,预计未来几年将快速增长,全球溶瘤病毒市场规模预计到2030年将达到24.79亿美元。
溶瘤病毒市场迫切的需要一针兴奋剂。随着Replimune Group在其他适应症上取得成功,让市场看到了溶瘤病毒技术方向诞生重磅产品的曙光。从摩熵医药数据库获悉,成立于2015年的Replimune Group是一家专注于开发溶瘤病毒疗法的生物技术公司,其核心策略是通过溶瘤病毒激活免疫系统对抗肿瘤。
摩熵医药数据库:融资信息
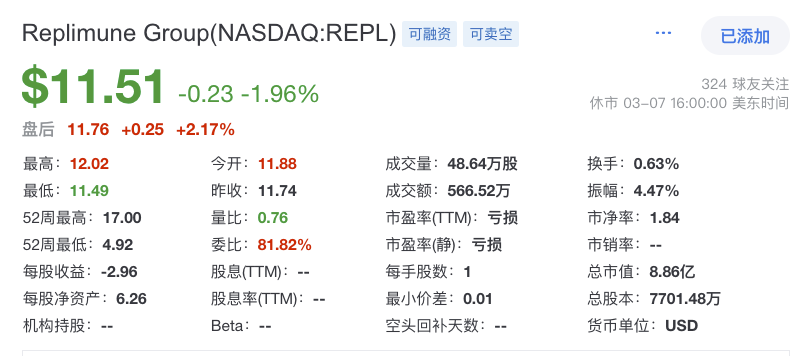
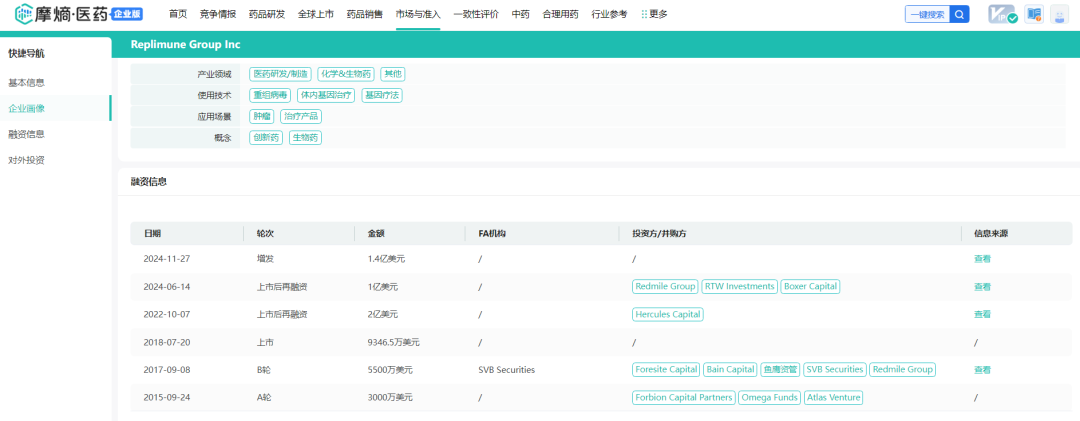
自2018年首次IPO以来,Replimune共筹集了约11.018亿美元净收益(包括IPO和公开发行),2024财年(2024.04-2025.03)前三季度净亏损为1.732亿美元。截止2024年12月31日,公司的累计赤字为8.744亿美元,拥有的现金、现金等价物和短期投资为5.365亿美元,预计当前的经济情况可以支持公司运营至2026年第四季度。
Replimune的RPx平台是其溶瘤病毒疗法的核心技术基础,核心原理是通过基因工程改造的疱疹病毒(HSV-1),使其选择性地感染并裂解肿瘤细胞,同时激活局部和全身性抗肿瘤免疫反应。基于RPx平台,公司已经开发了包括RP1、RP2和RP3等一系列溶瘤免疫疗法管线,这些管线针对不同的肿瘤类型和免疫状态,旨在最大限度的激活免疫系统对抗癌症,具有广阔的治疗前景。另外,公司的管线有望与大多数成熟和实验性的癌症治疗方法产生协同作用,从而实现单独开发或与其他多种治疗方案相结合的多功能性。截止发稿前市值为8.86亿美元,约合64亿人民币。

RP1(vusolimogene oderparepvec)是Replimune当前主要在研管线,基于HSV-1的选择性复制版本,表达了GALV-GP R和人类GM-CSF,旨在最大限度地提高肿瘤杀伤力、肿瘤细胞死亡的免疫原性以及全身抗肿瘤免疫反应的激活。
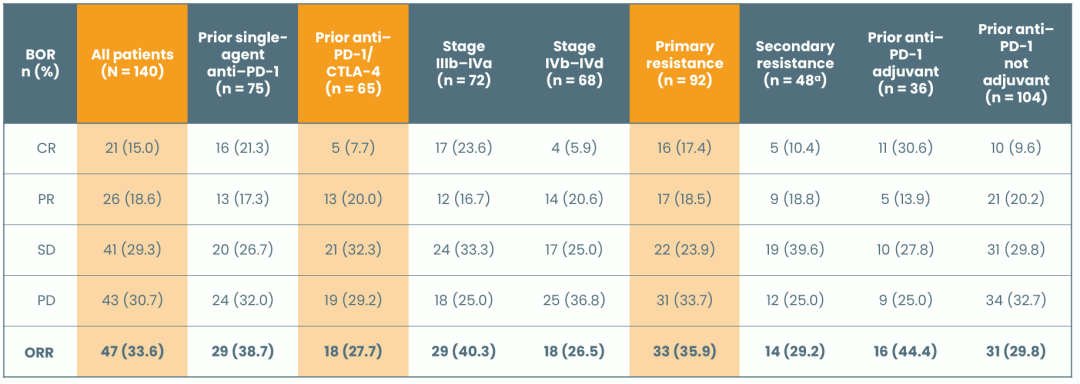
2025年1月21日,Replimune宣布FDA已受理RP1联合纳武利尤单抗治疗晚期黑色素瘤患者的BLA,该BLA主要基于IGNYTE试验(该试验评估RP1与纳武利尤单抗联合治疗抗PD-1治疗失败的黑色素瘤患者的效果)分析数据的支持。FDA授予该BLA优先审查权,PDUFA行动日期为2025年7月22日。进行的IGNYTE-3试验是RP1的临床试验3期确证研究,计划在全球100多个地点进行试验,该试验评估RP1与纳武利尤单抗联合治疗抗PD-1和抗CTLA-4治疗进展或不符合抗CTLA-4治疗条件的晚期黑色素瘤患者的效果。
另外,RP1还在进行ARTACUS试验和CERPASS试验。其中ARTACUS试验是评估RP1治疗肾、肝、心、肺或造血细胞移植患者皮肤恶性肿瘤的研究。这项临床试验1b/2期研究旨在研究RP1对接受过肾、肝、心、肺或其他实体器官移植或造血细胞移植患者皮肤恶性肿瘤的治疗效果,研究人员将研究这种疗法对患者的安全性,并评估其缩小肿瘤的能力。
CERPASS试验是一项临床试验2期研究,目的是比较单独使用西米普利单抗与RP1联合使用西米普利单抗治疗晚期皮肤鳞状细胞癌的效果,研究人员将研究这些疗法对肿瘤的疗效以及疗效的持续时间。
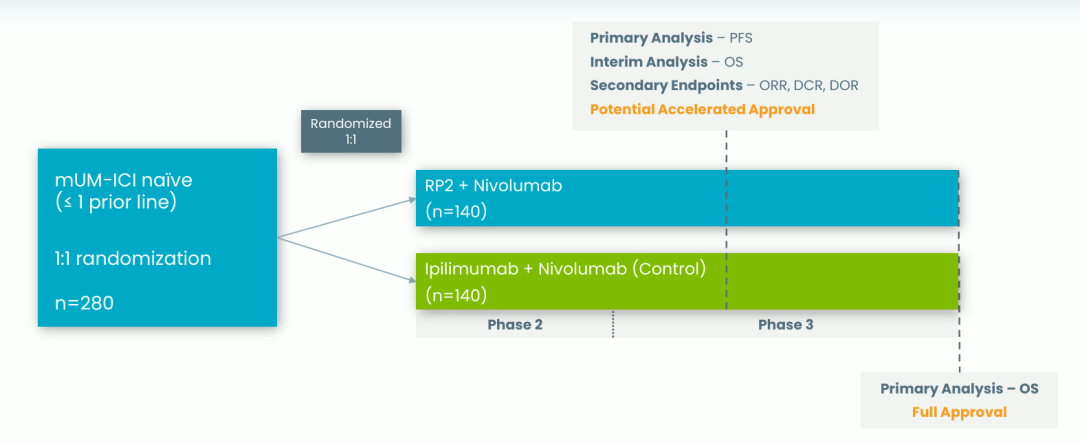
RP2在RP1的基础上进一步添加了抗CTLA-4抗体,旨在治疗更多免疫沉默的肿瘤类型,这种双重免疫激活策略有望进一步增强治疗效果。2025年1月初,Replimune宣布首批患者已被纳入RP2针对检查点不成熟的转移性葡萄膜黑色素瘤和二线复发或转移性肝细胞癌(HCC)的评估研究。这项RP2-202试验是一项临床试验2/3期研究,旨在评估RP2联合纳武利尤单抗与伊匹木单抗联合纳武利尤单抗治疗未接受过免疫检查点抑制剂治疗的成年转移性葡萄膜黑色素瘤患者的疗效,研究的主要终点是总生存期和无进展生存期,次要终点是总缓解率和疾病控制率。
针对肝细胞癌的临床试验2期研究(RP2-003试验,根据与罗氏公司签订的合作与供应协议进行)是一项开放标签试验,主要评估RP2与阿替利珠单抗和贝伐珠单抗二线疗法对局部晚期不可切除、复发和/或转移性肝细胞癌患者的联合治疗效果。另外,RP2-001-18试验是一项临床试验1期研究,旨在研究RP2单独或与纳武利尤单抗联合用于实体瘤患者,主要研究这种疗法对患者的安全性,并评估其缩小肿瘤的能力。
另外,RP3表达了免疫共刺激通路激活配体CD40L和4-1BBL,可以进一步增加免疫反应的效力,用于治疗免疫性冷肿瘤,这种策略有望使更多原本对免疫治疗不敏感的肿瘤患者受益。目前计划的有RP3-301试验,这项临床试验1期研究旨在评估RP3单独使用或与抗PD1疗法联合使用的疗效。
全球范围内,除了熟知的几个巨头外,其他研究溶瘤病毒/溶瘤细菌等免疫疗法的公司有华津医药、亦诺微医药、缮维特、阿诺医药、滨会生物、复诺健生物、威溶特医药、乐普/CG Oncology、TILTBiotherapeutics、荣瑞医药等。
其中:2025年1月,华津医药宣布其溶瘤细菌桑美威克®(SalMet-Vec®)收到美国食品药品监督管理局(FDA)签发的孤儿药资格认定(ODD),用于治疗胰腺癌(pancreatic cancer),这是桑美威克®继骨肉瘤、肝细胞癌、小细胞肺癌之后,获得FDA授予的第四项孤儿药资格认定。亦诺微医药的核心产品MVR-T3011 IT已获得FDA的快速通道认证,用于治疗复发或转移性头颈部鳞状细胞癌;阿诺医药引进的AN1004(pelareorep)是一款可静脉注射的溶瘤病毒,已获得FDA的快速通道资格,目前处于注册性试验阶段;CG Oncology的核心产品CG0070是一种溶瘤病毒疗法,已获得FDA的快速通道和突破性疗法认定,目前处于临床试验3期研究阶段......溶瘤病毒免疫疗法领域正在快速发展,众多公司通过技术创新和临床试验,不断探索其在多种癌症治疗中的应用,未来随着更多产品的获批和市场推广,溶瘤病毒免疫疗法有望成为肿瘤治疗的重要手段之一。
Feel free to call us on
025-85998075
Drop us a line anytime at
sales@popebiotech.com,
and we’ll get back
soon.
Come visit us at 南京市江宁区科学园乾德路5号