可以修正异常DNA序列而突破异常的基因作用,在光辉灿烂的理论性临床治疗前景和令人咋舌的高开发壁垒/投入之间,基因编辑疗法之路通往何方?
Metagenomi官网消息,已于2022年初完成超额认购的1.75亿美元B轮融资,用以推进管线布置并拓展基因编辑平台。

图片来源:Metagenomi官网
本轮融资由PFM Health Sciences、Farallon Capital Management和一家领先的全球投资公司牵头。同时包括Eventide Asset Management、Deep Track Capital、Frazier Life Sciences、Pura Vida Investments、Irving Investors、Millennium Management、Surveyor Capital(一家 Citadel 公司)、Marshall Wace、Novo Holdings A/S 和 Bristol Myers Squibb等一众投资者。本轮融资还包括战略合作伙伴 Moderna 以及现有投资者 RA Capital Management、拜耳 Leaps 和洪堡基金等的投资。

Metagenomi基因编辑工具(图片来源:Metagenomi官网)
Metagenomi 作为一家拥有多功能下一代基因编辑工具组合的基因药物公司,致力于通过利用下一代基因编辑工具来准确编辑当前技术无法实现的 DNA,从而开发潜在的治疗方法。目前已经获得总资金3 亿美元的融资,融资所得将用于推进 Metagenomi通过临床前开发、进入临床的体内和体外基因编辑治疗项目。
基因治疗途径包括ex vivo和in vivo两种途径,ex vivo是指将含外源基因的载体在体外导入人体自身或异体细胞(或异种细胞),经体外细胞扩增后,输回人体。ex vivo基因转移途径比较经典、安全,而且效果较易控制,但是步骤多、技术复杂、难度大,不容易推广;
in vivo 途径是将外源基因装配于特定的真核细胞表达载体,直接导入体内。这种载体可以是病毒型或非病毒性,甚至是裸DNA。in vivo基因转移途径操作简便,容易推广,但尚未成熟,存在疗效持续时间短,免疫排斥及安全性等一系列问题。
基因编辑又称基因组编辑或基因组工程,可以精确对生物体的基因组特定目标基因进行修饰。在针对基因功能研究的领域,基因编辑技术的出现使生物体遗传改造工程实现迅速进展。基因编辑用于药物治疗的大体思路是通过修正异常DNA序列而突破异常的基因作用,从而恢复其合理的生理功能。目前常用的基因编辑技术包括以下几种:
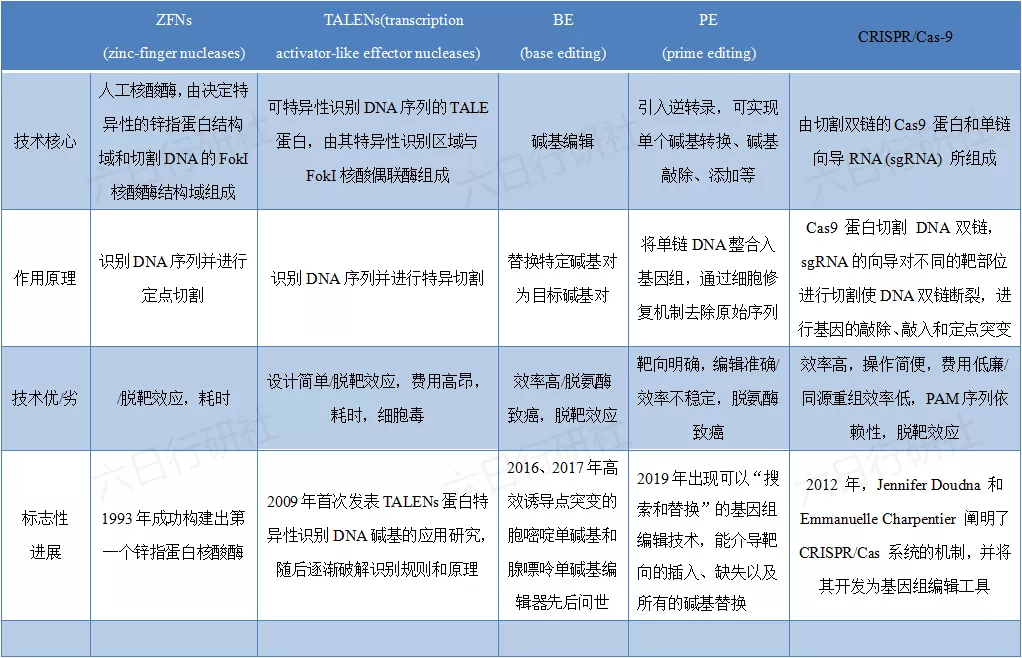
CRISPR:成簇的规则间隔的短回文重复,在逃避病毒攻击时,病毒 DNA 的小片段(约 20 bp)被切割并整合到细菌中的特定基因组位点,称为 CRISPR 阵列;Cas:CRISPR相关核酸内切酶。
表格中列出的CRISPR/Cas系统是细菌RNA引导的适应性免疫系统,通过短DNA片段存储噬菌体攻击的记忆,在同类噬菌体再次入侵时利用这些记忆对抗入侵者。CRISPR/Cas-9技术首次于2012年得以被阐明机制,用以作为基因编辑工具,并在2020年获得诺贝尔奖。因其易用性、多功能性和成本效益使之成为广受欢迎的基因编辑工具,目前在眼科疾病(年龄相关性黄斑衰退)、单基因遗传性疾病(镰状细胞病、地中海贫血)、肝病、细胞免疫疗法(CAR-T)改造及抗肿瘤等领域开展研究。
1. 年龄相关性黄斑衰退(age-related macular degeneration, AMD)
成人失明的主要原因,血管内皮生成因子VEGFA (vascular endothelial growth factor A, VEGFA)等血管生成因子基因高表达是造成病变的主要原因,发病中出现脉络膜新血管形成(choroidal neovascularization, CNV)。
有研究将Cas9 核糖核蛋白导入成年小鼠眼中,使视网膜色素上皮中VEGFA 基因失活,阻断AMD病程进展;而在AMD 的小鼠模型中发现cas9 RNPs 能有效减少脉络膜新血管生成的面积。这些科研证据初步表明CRISPR/Cas基因编辑技术具有开发AMD治疗方法的潜力。
2. 镰状细胞病(SCD)
镰状细胞病是一种异常血红蛋白引起的血液遗传病,红细胞呈镰刀状,可从细胞间闯过而导致终末组织缺氧;镰状细胞变形性差不易通过毛细血管,使血流减慢引起微血栓,导致不同部位剧烈疼痛;受损的红细胞如果出现急性溶血或脾增大易引起短期内死亡。尽管在几十年前就已经探究出SCD的遗传基础,但至今SCD的唯一治愈性疗法是造血干细胞移植,存在着相当大的治疗风险。
基于SCD的基因治疗策略已经初见成效,以慢病毒为载体向自体造血干细胞中添加抗镰刀形基因治疗获得成功。但慢病毒载体本身会给机体带来一定的感染或突变风险。相比之下基因编辑技术通过编辑患者自体造血干细胞和祖细胞纠正致病突变点、诱导引入血红蛋白突变的有益遗传。
3. 1型糖尿病
基因编辑技术公司CRISPR Therapeutics和再生医学公司 ViaCyte 合作开展的VCTX210 治疗1型糖尿病的Ⅰ期临床试验正在进行中,日前已经完成首位患者给药。VCTX210利用CRISPR技术敲除与T细胞供给相关的基因对干细胞进行基因编辑,分化出胰腺细胞移植入患者体内,使其逃避患者免疫系统的识别,重塑胰岛细胞的正常分泌过程。
……
基因编辑技术的应用不仅局限在基因疾病领域,根据疾病发病机制中的独特基因变化进行相应的基因编辑设计,能为已知疾病开发出更加高效、先进的疗法。还是以上述三个适应症为例,分析现行的治疗方案与基因编辑疗法进度做对比,结果如下:

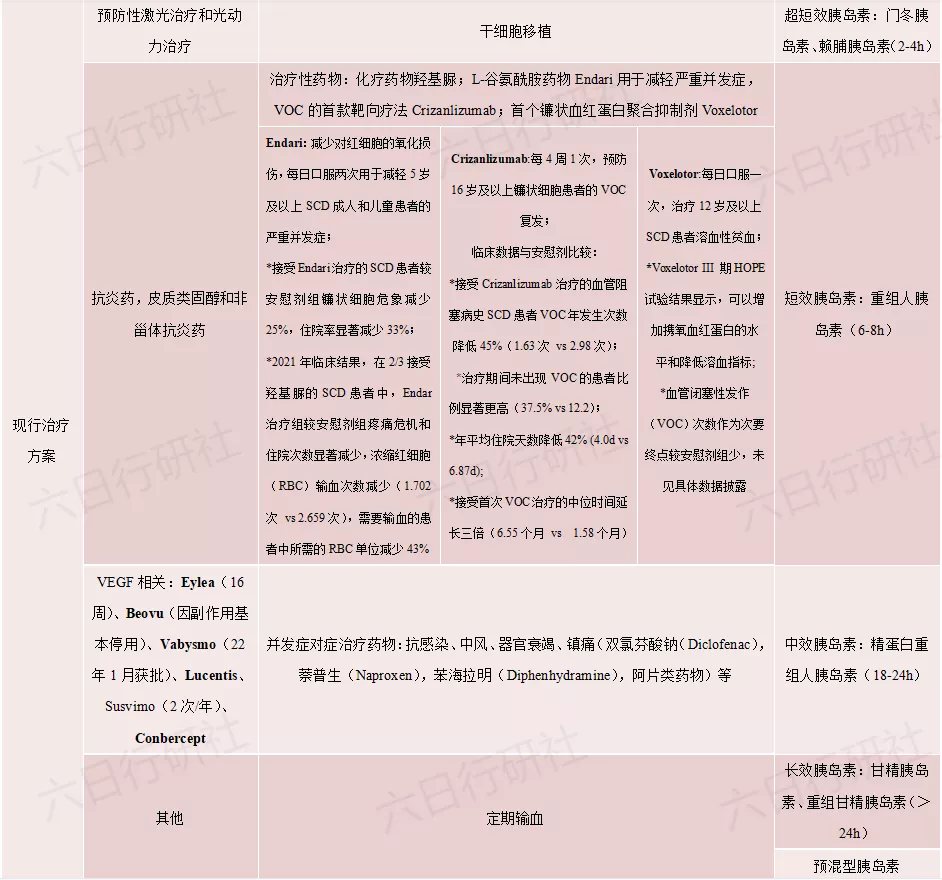

镰状细胞疼痛危象(SCPC)VOC可导致医疗保健的大量投入,它是SCD患者急诊室就诊和住院的最常见原因,每例患者的平均终身医疗费用约为100万美元,美国每年的医疗费用总额超过11亿美元。镰状细胞疼痛危象治疗:轻微疼痛可使用非处方醋氨酚,但无医嘱禁用布洛芬或萘普生;剧烈疼痛需急救或住院治疗,接受静脉输液、止痛药
目前基因编辑疗法正陆续开展各项适应症的临床试验,由于临床疗效与安全性结果未知、研发投入仍未停止,目前还无法准确评估基因编辑疗法可能的最终定价,不过根据已上市的基因治疗药物类比,由于基因编辑疗法前期投入的高研发成本和制备的高技术壁垒,加之基因疗法可以实现一次性治愈患者,免除终身用药所产生的花费,以及目前基因疗法的开发多始于罕见病领域,可以预见的是短时间内不会出现“物美价廉”的疗法。
基因编辑疗法目前基本选择在美国首发,1-3倍GDP区间意味着可接受6-18万美元/年的治疗费,对于这样一类新兴且开发及生产成本不菲的疗法,自由定价的美国市场无疑是最佳选择。这也是缘何Crizanlizumab和Voxeloto的定价均在12万美元/年左右。
基因疗法想要真正在中国做到,研发生产遍地开花,临床应用走入寻常百姓家,还得有些年头。
从TOP10的基因编辑公司公布的2021年的财务状况来看,基因疗法在被热捧的同时,也真的是当之无愧的碎钞机。除了CRISPR Therapeutics略有盈利外,其余9家公司,利润均为负,不过Biotech公司嘛,赌的是未来,早期烧钱也是情理之中的。CRISPR Therapeutics便是由两位诺奖获得者创办的基因编辑公司,其收入推测来自专利的许可费。
由于大部分企业2022年都将进入临床试验阶段,估计2022的财务赤字会更加惨不忍睹。
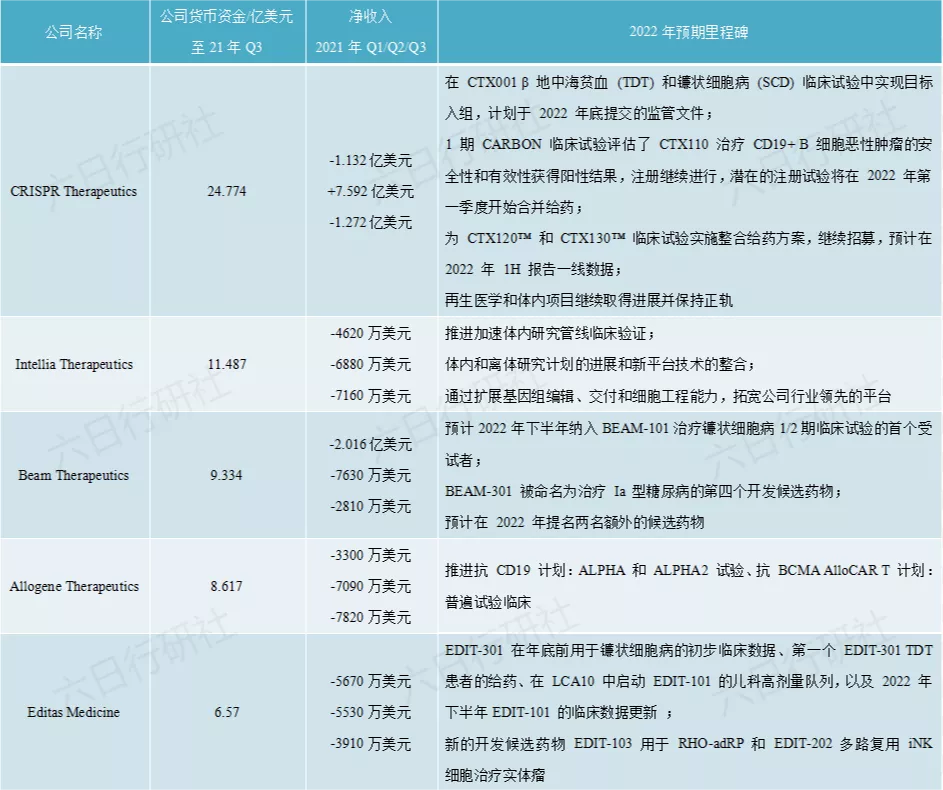
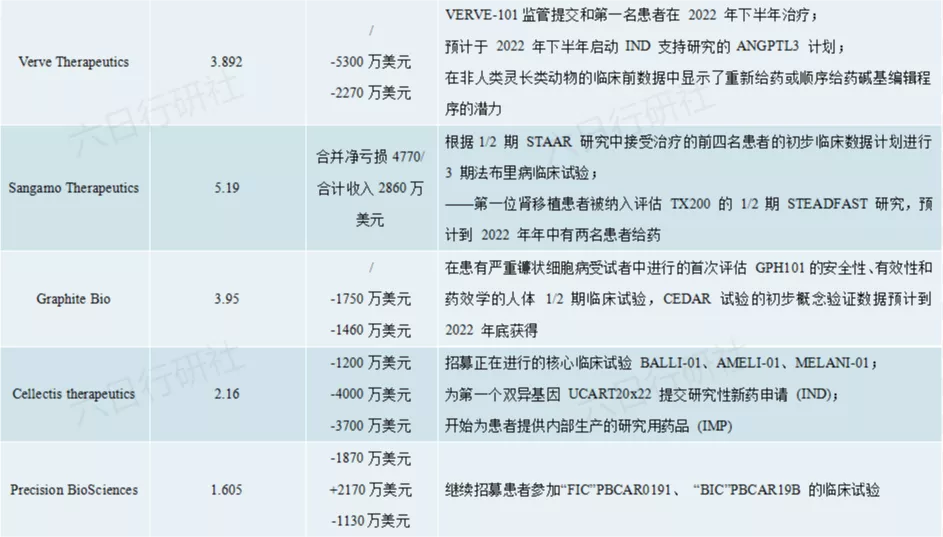
信息来源:公司官网2022年里程碑事件新闻稿与已公布财报
从基因编辑公司间的合作交易来看,主要是两种模式,一是与Biotech公司合作,目的是补充自己的管线,或是看中了对方的技术平台;二是与Big Pharma合作,主要是借助对方的资金、临床和商业化能力。基因编辑在人类的医疗史上,刚蹒跚起步,小而精的Biotech公司无疑是技术攻关难点突破的最佳狙击手,但正因为严重聚焦,所以不具备持续开发和独立商业化产品的能力。
选择旗鼓相当的伙伴抱团取暖,或是找个靠山谋求稳定发展,都是不错的选择。毕竟,已经参与了打响基因疗法第一枪的战斗,如何在战役中活下来才是最重要的。
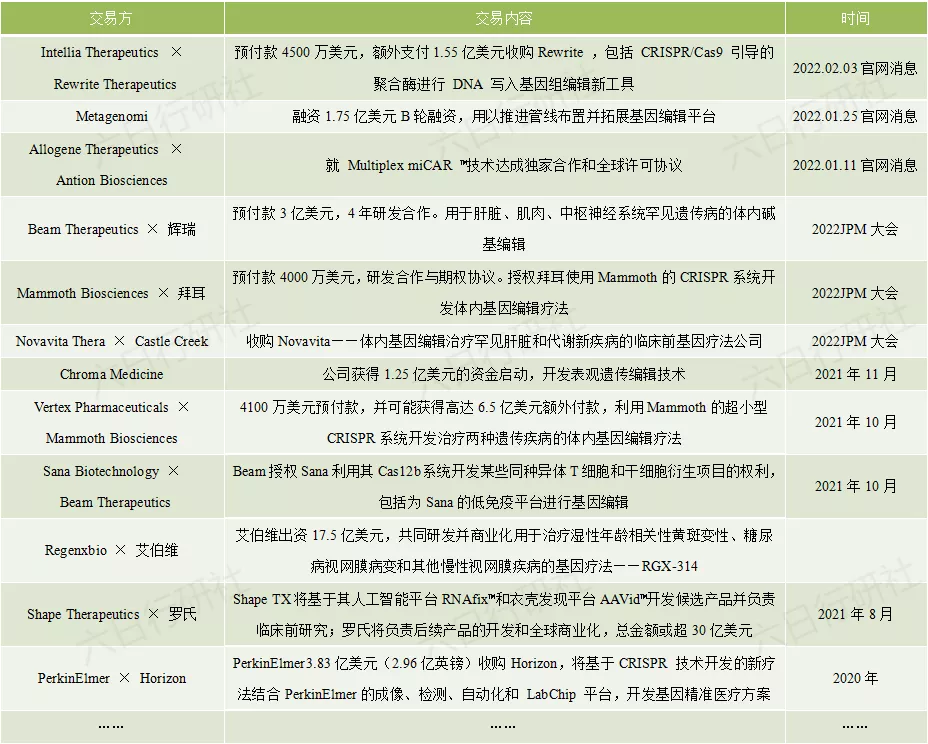
2021年是基因编辑技术快速发展的一年,2020年诺贝尔化学奖得主Jennifer Doudna团队找到在含有多个不同物种的群落中同时添加或修改基因的CRISPR “群落编辑” 方法;对 Cas9等多种Cas蛋白进行修饰以加强靶向识别效应,避免脱靶;刘如谦团队开发出Pro版先导编辑系统,在不引入DNA双链断裂和供体DNA模板的前提下,有效实现所有12种单碱基的自由转换,还能实现多碱基的精准插入与删除,可将编辑效率最高提升7倍;张锋团队发现更容易被改造和递送的新型基因编辑工具IscB蛋白……技术手段的发展是药物及疗法开发的基础,基因编辑工具的快速发展就像疗法开发所搭乘的一股扶摇直上的龙卷风。
2022年1月25日,Nature发文对2022年重点科学技术进行预测,指出基因组编辑的精确操作需求,文章提到了CRISPR-Cas9 技术精准定位和修复不足的特点,以及Prime 编辑和碱基编辑的安全性。同时还预测了Prime编辑发展前景可期。文中几次提到了编辑策略的安全性考虑,基因治疗除了需要关注有效性之外,其安全性、可控性才是具有“一票否决”性质的关键因素。
图片来源:Nature
2019年基因编辑婴儿在国内掀起轩然大波,公众对于“基因编辑”在疾病治疗领域的概念可能不一定清晰,但这四个字背后所代表的基因改造风险足以给人留下最直观的误解和恐慌。要想实现技术的充分发展,还需要时间和时机广泛普及基因编辑疗法概念。不过即使是在运用基因编辑工具开发疾病新疗法的试验中也存在着未知的风险。
2019年有Nature 文章指出CRISPR-Cas9基因编辑过程中的DNA双链断裂过程可能出现染色体碎裂,这一种破坏性的基因组重排形式可能会进一步导致致癌融合蛋白的出现或特定基因表达失调。2021年,在Allogene 公司基因编辑抗CD19 CAR-T候选药物ALLO-501A治疗时,一名淋巴瘤患者体内出现染色体异常的CD19 CAR-T细胞,所有血细胞系减少,由于染色体异常潜在的致癌风险,Allogene 所有CAR-T临床试验均被叫停,除自家股价外,连带几家同类CAR-T疗法公司及上市基因编辑公司股价一起下跌。
如何实现基因精确定位、断裂、修复、编辑,杜绝未知风险因素产生的影响,始终是基因编辑领域需要持续关注的焦点。
本文摘自---药精通 Bio
Feel free to call us on
025-85998075
Drop us a line anytime at
sales@popebiotech.com,
and we’ll get back
soon.
Come visit us at 南京市江宁区科学园乾德路5号