2025年2月10日,美国生物制药公司Sionna Therapeutics宣布完成2.192亿美元首次公开募股(纳斯达克股票代码“SION”)。这是继来自中国的亚盛医药、Metsera和Maze Therapeutics之后又一家抓住IPO窗口期成功登陆纳斯达克的制药公司。

据药融云数据,www.pharnexcloud.com;改名后为摩熵医药数据显示,Sionna Therapeutics成立于2019年,是一家临床阶段生物制药公司,致力于开发囊性纤维化(CF)新型治疗方法,革新CF患者的现有治疗模式。
囊性纤维化(CF)是由CFTR(囊性纤维化跨膜电导调节因子)基因突变引起,该基因突变可导致CFTR蛋白的功能减弱或完全丧失。CFTR基因及其编码的CFTR蛋白由华裔科学家徐立之在1989年发现。
据囊性纤维化基金会(CFF)估计,在94个国家中,约有10.6万人被诊断出患有囊性纤维化,在美国约有3.3万名成人和儿童囊性纤维化患者。上世纪三十年代,囊性纤维化被首次记载,当时患者的预期寿命不到1岁,随着囊性纤维化治疗方法的进步,患者生活得到了改善,但根据2023年CFF患者登记的数据,2019年至2023年间在美国囊性纤维化患者的预期中位生存年龄仍然只有61岁。
当前全球囊性纤维化新药领域呈现出福泰制药(Vertex Pharmaceuticals)一家独大的局面。福泰制药开发的Kalydeco(ivacaftor)于2012年在美国首次获批。该药是一种CFTR增效剂,可使患者体内缺陷性CFTR蛋白发挥正常功能。虽然该药只能治疗4%的囊性纤维化患者,但却是全球首款靶向囊性纤维化根本病因的药物。
之后,福泰制药又推出了多款新药,2019年上市的三联疗法Trikafta(elexacaftor/tezacaftor/ivacaftor和ivacaftor)能够治疗90%的囊性纤维化患者。2024年Trikafta(美国商品名)/Kaftrio(欧洲商品名)总销售额达到了创纪录的102.39亿美元。2024年12月,美国FDA又批准了福泰制药的第二代三联疗法Alyftrek(vanzacaftor/tezacaftor/deutivacaftor)。
值得注意的是,大约90%的囊性纤维化患者携带至少一个ΔF508突变。ΔF508突变,即CFTR蛋白的NBD1(核苷酸结合域1)中第508位氨基酸苯丙氨酸的缺失,携带这种突变的个体往往处于囊性纤维化最严重的情况,因为这些患者上皮细胞中CFTR的功能几乎或完全缺失。对于携带ΔF508突变的患者,目前的标准治疗方案就是福泰制药的Trikafta。
然而,当前囊性纤维化治疗的一个痛点在于所有获批的CFTR调节剂都不能直接稳定NBD1。
Sionna认为,通过开发以NBD1为靶点的疗法,仍有机会为囊性纤维化患者提供具有临床意义的益处。NBD1长期以来被认为是恢复正常CFTR功能的重要靶点,因为最常见的导致囊性纤维化的ΔF508突变就位于此处,但它一直被视为是“不可成药”靶点。
据该公司招股书描述,至少有三分之二服用Trikafta(标准治疗方案)的患者未能达到正常的CFTR功能水平,即汗液氯离子浓度低于30 mmol/L的标准。即使接受了治疗,随着时间的推移,患者的CFTR功能仍可能继续降低,带来的影响包括呼吸道感染、肺部恶化,以及持续的肺功能下降。超过6000名患者已经停用CFTR调节剂。这类患者几乎没有其他替代疗法来改善临床结果或生活质量。此外,由于耐受性问题,一些服用Trikafta的患者不得不减少剂量。
Sionna希望为囊性纤维化患者提供更多的治疗选择,支持可能为囊性纤维化患者提供临床益处的新作用机制药物,并为那些在使用Trikafta时出现耐受性问题的患者提供替代方案。
前赛诺菲高管创业,基金会创始支持,
前福泰高管加入
据招股书披露,Sionna的两位联合创始人Greg Hurlbut博士(前赛诺菲健赞的蛋白质构象疾病和罕见肺病研究负责人)和Mark Munson博士(前赛诺菲美国药物化学负责人)曾在赛诺菲花了十多年时间广泛研究NBD1靶点。其中,Greg Hurlbut博士曾是囊性纤维化基金会治疗药物开发项目3200万美元赠款的首席研究员,他的研究为靶向ΔF508-CFTR的小分子开发策略提供了基础。
在Sionna成立之前,囊性纤维化基金会(CFF)在十多年时间里资助了赛诺菲的早期ΔF508校正剂发现工作,为Sionna后来的产品线做出了重要贡献。
2019年12月,Sionna与赛诺菲订立许可协议,获得了当时赛诺菲CFTR调节剂的全球独家许可。现在这项许可涉及Sionna管线中的三个项目:SION-719、SION-109和SION-451。在此次合作中,赛诺菲获得150万美元预付款,以及30万美元的研发费用报销,未来还有机会获得总计高达4000万美元的后期开发和商业里程碑。
Sionna在同一时间与囊性纤维化基金会(CFF)订立付款协议,据此,Sionna将向CFF提供补偿,以换取CFF授予或暂不执行其先前与赛诺菲签订的许可协议下拥有的某些权利。根据该协议,Sionna将有义务就其与赛诺菲许可协议下开发和商业化的产品向CFF提供补偿。Sionna已向CFF支付了20万美元的预付款,并向CFF发行了300,300股种子优先股,价值100万美元。CFF未来还有资格获得总计高达4000万美元的后期开发和商业里程碑。
另外我们注意到,Sionna的首席医学官Charlotte McKee博士曾担任福泰制药的临床开发副总裁,她将福泰的多款CFTR调节剂引入囊性纤维化患者并扩大了适应症。Sionna的科学顾问委员会中还包括华人科学家杨台莹(Taiyin Yang)博士,她是美国国家工程院院士。
Sionna在研管线进展
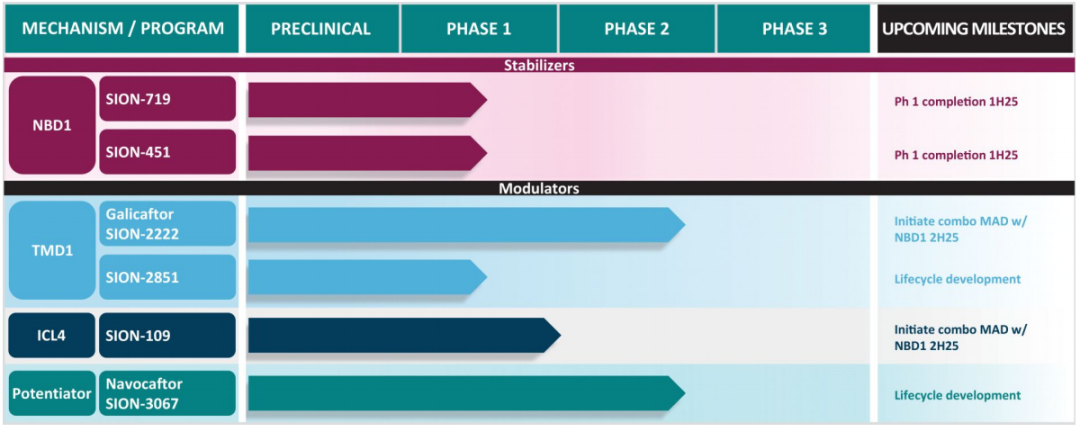
Sionna的目标是通过专有的双重组合疗法或作为标准护理的附加疗法来扩展囊性纤维化当前的治疗模式。
Sionna采用了生物物理、基于细胞以及虚拟筛选的方法,并广泛使用结构生物学来指导新型小分子NBD1稳定剂的优化。其管线中的两款高效小分子NBD1稳定剂,即SION-719和SION-451,是该公司的核心项目,旨在通过靶向CFTR蛋白的NBD1,从而恢复该蛋白的功能,使其“尽可能接近正常”。
这两款小分子正在澳大利亚进行随机、双盲、安慰剂对照的1期临床试验,旨在评估单次和多次递增剂量在健康受试者中的安全性、耐受性和药代动力学特征。
截至2025年1月14日,Sionna已完成SION-719的五个单次剂量递增(SAD)队列和三个多次剂量递增(MAD)队列的研究,超过60名健康受试者完成给药。SION-451也完成了六个SAD队列和三个MAD队列的研究,超过70名健康受试者完成给药。基于截至2025年1月14日的1期临床数据的中期分析,SION-719和SION-451总体上耐受良好。
基于Sionna的临床前囊性纤维化人支气管上皮(CFHBE)模型,该公司为SION-719和SION-451建立了目标暴露水平,以便其作为双重组合疗法的一部分或添加到当前的标准治疗方案(SOC)中时提供潜在的具有临床意义的益处。在这些试验中,公司已经通过单次和多次给药达到了SION-719和SION-451的目标浓度,并计划继续招募健康受试者进入更多的MAD队列。据披露,这两个项目的1期研究主要结果预计将于2025年上半年公布,2a期试验或将于2025年下半年启动。
Sionna也在开发一系列互补的CFTR调节剂,旨在与公司开发的NBD1稳定剂协同工作以提高CFTR功能,这已在临床前模型中得到验证。
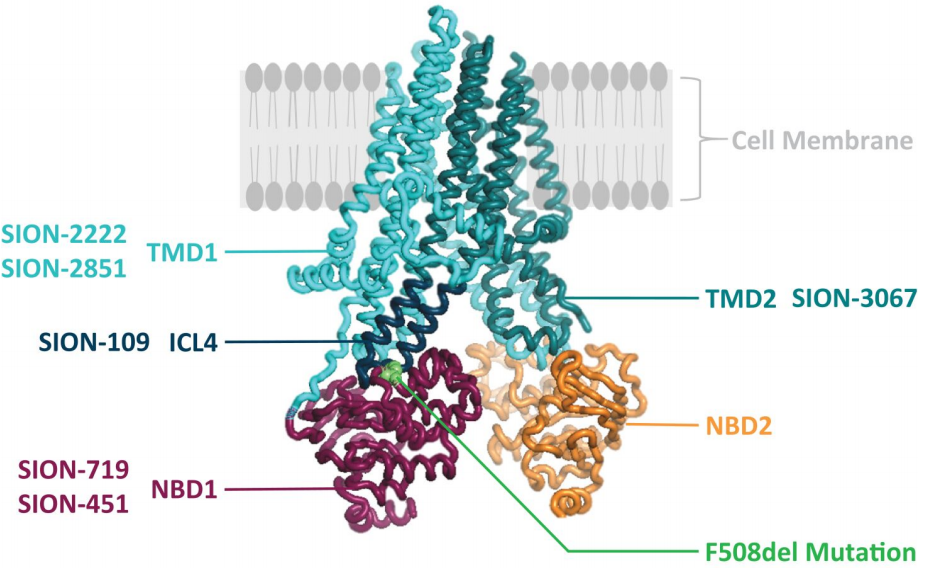
Sionna最近完成了一项评估SION-109的1期临床试验,SION-109是一种ICL4(细胞内环4)导向的CFTR校正剂。在该1期试验的所有部分中,SION-109在所有剂量水平下通常耐受良好。SION-109作为与SION-451或SION-719双重组合疗法的一部分,通过单次和多次给药达到了目标暴露。
以上三个项目均来自前文提到的,Sionna与赛诺菲和囊性纤维化基金会(CFF)的合作。
2024年7月,Sionna从艾伯维获得了三种处于临床阶段的化合物的全球独家许可,以扩大其囊性纤维化产品线,包括TMD1导向的CFTR校正剂Galicaftor(SION-2222,前称ABBV-2222)和SION-2851(前称ABBV-2851),以及TMD2导向的CFTR增强剂Navocaftor(SION-3067,前称ABBV-3067)。
在艾伯维开展的研究中,Galicaftor已完成2期临床试验,该药在1期和2期试验中通常耐受性良好,观察到单药治疗的汗液氯化物水平改善以及与Navocaftor联合治疗的汗液氯化物和肺功能改善;SION-2851已经在健康志愿者中完成了1期SAD试验;Navocaftor已在2期试验中进行了评估,其作为联合疗法的潜力已被证明。
根据此前新闻稿披露,Sionna将在此次合作中优先推进其中一种化合物和SION-109作为首个NBD1稳定剂的潜在双重组合疗法。在该合作中,Sionna向艾伯维支付了500万美元预付款、并向艾伯维发行了1,414,445股公允价值为860万美元的普通股,艾伯维还将有资格获得后期开发和商业里程碑付款,以及基于产品的净销售额的特许权使用费。
另据药融云数据,www.pharnexcloud.com;改名后为摩熵医药数据显示,艾伯维此次授权给Sionna的三款候选药物均是由比利时公司Galapagos原研,艾伯维与Galapagos的合作始于2013年。因此,Sionna未来也有可能会向Galapagos支付一定的款项。

图源:摩熵医药数据
Sionna计划在这些NBD1稳定剂候选药物和互补调节剂候选药物中选择最有前景的推进到后期开发阶段。公司最初打算在一个概念验证试验中评估其进度领先的NBD1稳定剂与当前的标准治疗方案Trikafta联合使用的效果。同时,Sionna将确定该公司认为最适合在囊性纤维化患者中进行后期临床试验的专有双重组合疗法。

融资及财务状况
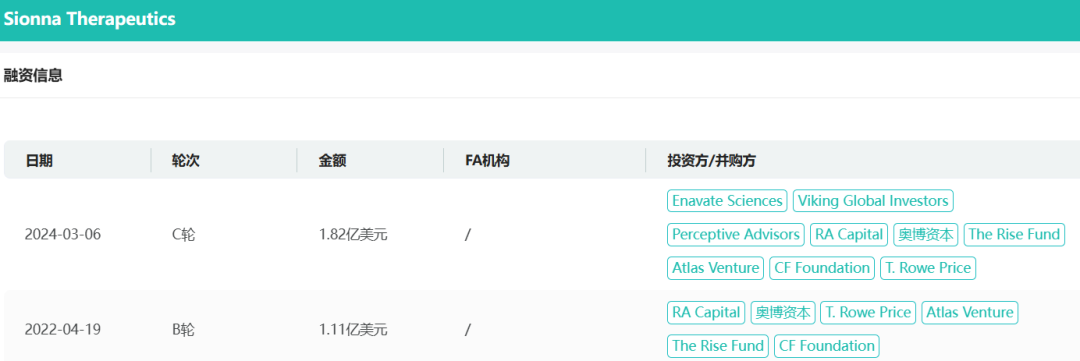
自成立以来,Sionna已从RA Capital、TPG的the Rise Fund、Atlas Venture、OrbiMed和Enavate Sciences等投资者那里筹集了约3.3亿美元。公司还获得了囊性纤维化基金会(CFF)的创始支持,CFF一直是其研发工作的忠实投资者和支持者。
图源:摩熵医药数据
Sionna近期财务数据:

2024年前九个月研发费用分布如下:
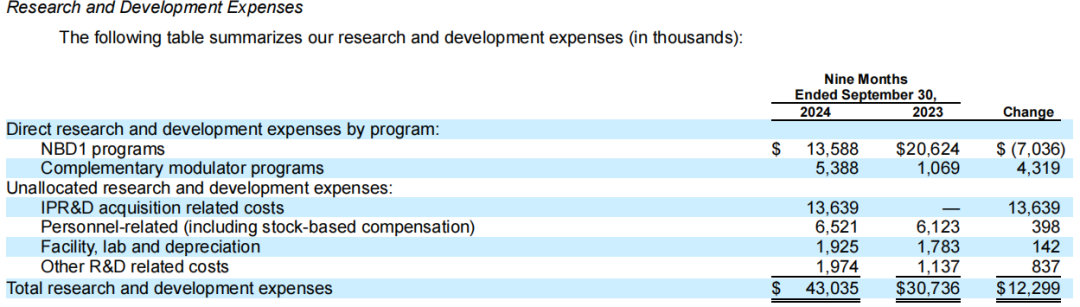
截至2024年12月31日,Sionna拥有现金、现金等价物和有价证券约为1.68亿美元。截至2025年2月11日收盘,该公司市值为8.68亿美元。截止今日发稿前市值为6.29亿美元。
参考:
NMPA/CDE;
FDA/EMA/PMDA;
相关公司公开披露;
摩熵医药数据pharma.bcpmdata.com(原药融云数据);
Sionna Therapeutics网站、招股书;
https://investors.sionnatx.com/news-releases/news-release-details/sionna-therapeutics-announces-closing-2192-million-upsized;
罕见病患者的“自救”与“群救”:一个新的药物开发模式 | 深究科学
其他相关公开信息(正文图片均来自企业官方,除非另有说明)。
Feel free to call us on
025-85998075
Drop us a line anytime at
sales@popebiotech.com,
and we’ll get back
soon.
Come visit us at 南京市江宁区科学园乾德路5号