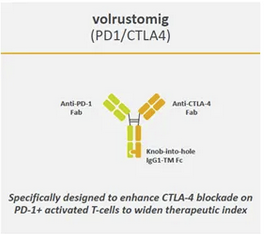
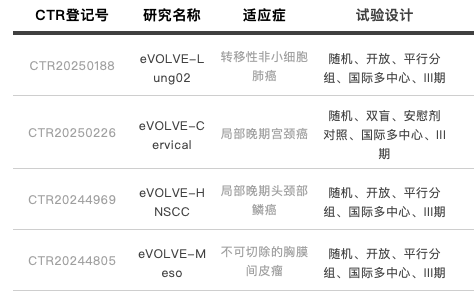
药融圈监测显示:一项确定Volrustomig(MEDI5752)联合化疗对比帕博利珠单抗联合化疗一线治疗转移性非小细胞肺癌(mNSCLC)患者疗效的双臂、平行、随机、多中心、开放标签、全球III期研究(eVOLVE-Lung02)近期已在中国有序开展。中国临床试验登记号为CTR20250188。早年在2007年,阿斯利康通过斥资156亿美元收购MedImmune,MedImmune的双特异抗体平台DuetMab平台。在此之前,其本身并不具备该领域技术能力。Volrustomig/沃苏米单抗是一款PD-1/CTLA-4双抗候选分子。目前全球进度最快为3期阶段,也是AZ最快的双抗,其中肺癌领域研究为NCT05984277(eVOLVE-Lung02)等。
药融云数据,www.pharnexcloud.com;改名后为摩熵医药数据
此前陆续在AACR ASCO WCLC 发布过本品RCC 、NSCLC等等相关临床结果。部分数据显示,2024年WCLC披露的Volrustomig联合化疗即使在PD-L1表达低于1%的NSCLC患者中也有可观效果,非鳞状细胞癌(Nsq)(n=78)和鳞状细胞癌(Sq)(n=10)队列的ORR分别为42.3%和50.0%,而传统免疫疗法对这类患者或无效。2024年ASCO上发布了GEMINI-Hepatobiliary:基于新型免疫疗法一线治疗晚期肝胆肿瘤患者的Ⅱ期研究,一项Ⅱ期、开放标签、多药物、多中心、主研究方案的临床试验,旨在评估新型IO双抗单药疗法或与标准抗肿瘤药物联合治疗晚期肝细胞癌(HCC)和胆道癌(BTC)患者的初步疗效和安全性。2025年1月24日,在中国开始开展Volrustomig治疗高风险局部晚期宫颈癌女性的全球3期临床研究(CTR20250226)。本次临床试验的主要终点是 PFS。该试验共有 213家site参与,国内计划入组130名受试者。全球临床研究命名eVOLVE-Cervical。
中国是阿斯利康全球第二大市场与重要的科创引擎,到2030年预计在中国上市10余款肿瘤重磅产品与80多个新适应症。阿斯利康希望成为中国肿瘤领域的领先企业。目前的投资或者临床开发进度都在加快。